Vaccini
Vaccini COVID-19
Informazioni generali sulla vaccinazione per COVID-19
Si parla molto dei vaccini COVID-19, spesso anche in maniera confusa. In questa sezione abbiamo ritenuto di riferirci a una fonte autorevole, rappresentata dal Center for Disease Control (CDC).
Cosa hai bisogno di sapere
I vaccini COVID-19 sono efficaci nel proteggere l’individuo vaccinato dalla malattia severa causata dalle diverse varianti attualmente in circolazione (tra cui la variante Delta) del virus che causa il COVID-19.
I vaccini generano una risposta immunitaria, sia della componente umorale (anticorpi), sia della componente cellulare (linfociti T). Proteggono dalla malattia, ma non evitano in assoluto l’infezione, quindi anche se sei vaccinato rimane necessario indossare una mascherina quando ti trovi in un ambiente al chiuso, in pubblico, per massimizzare la protezione dalla variante Delta ed eventualmente diffonderla ad altri.
Che cosa stiamo ancora imparando
- Quanto bene i vaccini proteggono le persone con un sistema immunitario indebolito (comprese le persone che assumono medicinali che sopprimono il sistema immunitario).
- Per quanto tempo i vaccini COVID-19 proteggono le persone.
- Quante persone devono essere vaccinate contro il COVID-19 prima che la popolazione possa essere considerata protetta (immunità di popolazione).
- Quanto sono efficaci i vaccini contro le nuove varianti del virus che causa il COVID-19.
Che cosa sappiamo oggi
I vaccini COVID-19 sono efficaci nel proteggerti dal COVID-19, in particolare da malattie gravi e morte. Inoltre riducono il rischio che le persone diffondano il virus che causa il COVID-19. Se sei completamente vaccinato, puoi riprendere le attività che svolgevi prima della pandemia.
I vaccini attualmente autorizzati sono stati studiati per indurre una risposta immunitaria capace di bloccare la proteina Spike, e quindi di impedire al virus di entrare nelle cellule umane per infettarle.
- induce un alto tasso di immunizzazione, tra i soggetti trattati la percentuale di soggetti che si riammalano deve essere molto bassa;
- l’agente infettivo non muta nel tempo. Cambiando, il virus può sfuggire alla protezione indotta dal vaccino;
- l’immunità acquisita si mantiene.
Tabella dei Contenuti
Panoramica sui vaccini anti COVID-19
Vaccini
Tipi di vaccini COVID-19
I vaccini attualmente disponibili e il cui utilizzo è stato autorizzato da EMA (European Medicines Agency) e AIFA (Agenzia Italiana del Farmaco) si dividono in due categorie in base al diverso meccanismo d’azione: vaccini a mRNA e vaccini a vettore virale.
Vaccini a mRNA
I vaccini a mRNA utilizzano molecole di acido ribonucleico per far arrivare in alcune cellule della persona immunizzata le istruzioni che consentono di produrre temporaneamente la proteina Spike presente sulla superficie del coronavirus SARS-Cov-2.
In questi vaccini, un piccolo segmento di mRNA del virus è inserito all’interno di microscopiche vescicole lipidiche che si fondono con le cellule umane. Una volta giunto nella cellula, il segmento di mRNA virale avvia la temporanea produzione delle proteine Spike che stimolano la risposta immunitaria, la quale consisterà nella attivazione dei linfociti e nella produzione di anticorpi specifici.
Attualmente è stato approvato l’uso di due vaccini a mRNA, il vaccino Pfizer mRNA BNT162b2 (Comirnaty) e il vaccino Moderna mRNA -1273.
Questi due vaccini contengono polietilenglicole (PEG), quindi se la persona in passato ha sviluppato una reazione grave o non grave ma immediata (cioè entro 4 ore) a farmaci o vaccini contenenti questa categoria di sostanze, si renderà necessaria la valutazione allergologica e la somministrazione del vaccino in un ambiente protetto dove sarà possibile gestire in sicurezza eventuali reazioni avverse.
Il vaccino Pfizer mRNA BNT162b2 (Comirnaty) è al momento destinato ai soggetti di età pari o superiore ai 12 anni, ed in Italia è stato autorizzato il 22 dicembre 2020. Questo vaccino è somministrato in due iniezioni, solitamente effettuate nella zona muscolare superiore del braccio, a distanza di almeno 21 giorni l’una dall’altra; qualora si rendesse necessario dilazionare di alcuni giorni la seconda dose, la Commissione Tecnico Scientifica di AIFA precisa che non è possibile superare in ogni caso l’intervallo di 42 giorni.
Il vaccino Moderna mRNA -1273 (Spikevax) è al momento destinato ai soggetti di età pari o superiore ai 12 anni, ed in Italia è stato autorizzato il 7 gennaio 2021. Questo vaccino è somministrato in due iniezioni, solitamente effettuate nella zona muscolare superiore del braccio, a distanza di almeno 28 giorni l’una dall’altra; qualora si rendesse necessario dilazionare di alcuni giorni la seconda dose, la Commissione Tecnico Scientifica di AIFA precisa che non è possibile superare in ogni caso l’intervallo di 42 giorni.
Vaccini a vettore virale
I vaccini a vettore virale utilizzano un adenovirus incapace di replicarsi, per trasportare all’interno delle cellule umane un piccolo frammento di DNA di coronavirus SARS-Cov-2 che codifica per la proteina Spike. Contro di essa, il sistema immunitario si attiva e produce gli anticorpi specifici in grado di attaccare e distruggere il coronavirus SARS-Cov-2, nel caso di un eventuale contatto con esso.
Attualmente nei soggetti a partire dai 18 anni d’età è stato approvato l’uso di due vaccini a vettore virale, il vaccino Vaxzevria (ex COVID-19 Vaccine Astrazeneca) e il vaccino Janssen.
Questi vaccini contengono polisorbati, quindi se la persona in passato ha sviluppato una reazione grave, o non grave ma immediata (cioè entro 4 ore) a farmaci o vaccini contenenti questa categoria di sostanze, si renderà necessaria la valutazione allergologica e la somministrazione del vaccino in un ambiente protetto, dove sarà possibile gestire in sicurezza eventuali reazioni avverse.
Il vaccino Vaxzevria (ex COVID 19 Vaccine Astrazeneca) è destinato ai soggetti di età pari o superiore ai 18 anni ed è raccomandato nei soggetti di età superiore ai 60 anni; in Italia è stato approvato il 30 gennaio 2021. Questo vaccino viene somministrato in due dosi, solitamente a livello della zona muscolare superiore del braccio, a distanza di 4-12 settimane l’una dall’altra.
Il vaccino Jansenn è destinato ai soggetti di età pari o superiore ai 18 anni ed è raccomandato nei soggetti di età superiore ai 60 anni; in Italia è stato approvato il 21 marzo 2021. Questo vaccino viene somministrato in un’unica dose, solitamente nella parte muscolare superiore del braccio.
Quante dosi di vaccino eseguire
I vaccini COVID-19 insegnano al nostro sistema immunitario come riconoscere e combattere il virus che causa il COVID-19. In genere occorrono 2 settimane dopo la vaccinazione affinché l’organismo crei una protezione (immunità) contro il virus che causa il COVID-19. Ciò significa che è possibile che una persona possa ancora contrarre il COVID-19 prima o subito dopo la vaccinazione e poi ammalarsi perché il vaccino non ha avuto abbastanza tempo per costruire una protezione.
Le persone sono considerate completamente vaccinate due settimane dopo la loro seconda dose dei vaccini Pfizer-BioNTech o Moderna COVID-19, oppure 2 settimane dopo il vaccino monodose Janssen COVID-19 di Johnson & Johnson.
Le persone con un sistema immunitario da moderato a gravemente compromesso dovrebbero ricevere una dose aggiuntiva di vaccino mRNA COVID-19 dopo le 2 dosi iniziali.
Cosa stiamo ancora imparando?
Stiamo ancora imparando quanto efficacemente i vaccini COVID-19 proteggano le persone con un sistema immunitario indebolito, comprese le persone che assumono farmaci che sopprimono il sistema immunitario.
Inoltre stiamo ancora imparando per quanto tempo i vaccini COVID-19 proteggono le persone.
Se hai una condizione medica o stai assumendo farmaci che indeboliscono il tuo sistema immunitario, dovresti parlare con il tuo medico. Potrebbe essere necessario continuare a prendere tutte le precauzioni per prevenire la malattia da COVID-19.
Sicurezza dei vaccini
Cosa sappiamo
I vaccini COVID-19 sono sicuri ed efficaci. I vaccini non possono trasmettere il COVID-19. Potresti avere effetti collaterali dopo la vaccinazione. Questi sono normali e dovrebbero andare via in pochi giorni.
Gli effetti collaterali della vaccinazione COVID-19, come stanchezza, mal di testa o brividi, possono influire sulla capacità di svolgere le attività quotidiane, ma dovrebbero scomparire in pochi giorni.
Riportiamo di seguito parte un breve estratto del Ottavo Rapporto AIFA sulla sorveglianza dei Vaccini COVID-19, pubblicato da AIFA (Agenzia Italiana del Farmaco) a settembre 2021.
Introduzione
Nessun prodotto medicinale può essere mai considerato esente da rischi.
Verificare che i benefici di un vaccino siano superiori ai rischi e ridurre questi al minimo, è responsabilità delle autorità sanitarie che regolano l’immissione in commercio dei prodotti medicinali.
Servirsi di un farmaco in maniera corretta, ponderata e consapevole, è responsabilità di tutti. Il nostro Paese è dotato di un sistema di farmacovigilanza che, ormai da molti anni, dedica un’attenzione particolare e un apposito impianto organizzativo proprio al monitoraggio di quello che succede dopo la somministrazione di un vaccino. Si tratta di un sistema aperto, dinamico, cui tutti (professionisti sanitari, pazienti, genitori, cittadini) possono inviare le proprie segnalazioni contribuendo al monitoraggio dell’uso sicuro dei vaccini e dei medicinali in genere. Inoltre, il sistema ha piena trasparenza e offre l’accesso ai dati aggregati, interrogabili sul sito web dell’AIFA.
Guida alla lettura dei dati
Il Rapporto AIFA descrive le segnalazioni di reazioni che sono state osservate dopo la somministrazione del vaccino. Ciò non significa che queste reazioni siano state causate dal vaccino. Potrebbero infatti essere un sintomo di un’altra malattia, o potrebbero essere associate a un altro prodotto assunto dalla persona che si è vaccinata. Indagare sul significato e sulle cause di queste reazioni è compito della farmacovigilanza.
Per orientarsi in questo processo di indagine e analisi è necessario sapere distinguere i seguenti termini.
Evento avverso
è un qualsiasi episodio sfavorevole che si verifica dopo la somministrazione di un farmaco o di un vaccino, ma che non è necessariamente causato dall’assunzione del farmaco o dall’aver ricevuto la vaccinazione.
Reazione avversa
è una risposta nociva e non intenzionale a un farmaco o a una vaccinazione per la quale è possibile stabilire una relazione causale con il farmaco o la vaccinazione stessa. Per distinguere, quindi, se siamo di fronte a un evento avverso o a una reazione avversa, dobbiamo valutare se è possibile risalire a una causa legata al prodotto medicinale. Non è sufficiente che l’evento si sia verificato a breve distanza dalla vaccinazione o dall’assunzione del farmaco.
Effetto indesiderato
è un effetto non intenzionale connesso alle proprietà del farmaco o del vaccino, che non è necessariamente nocivo ed è stato osservato in un certo numero di persone. Si tratta quindi di un possibile effetto noto, verificatosi nel corso del tempo e considerato accettabile.

Vaccino Pfizer mRNA BNT162b2 (Comirnaty)
La maggior parte di sospetti eventi avversi successivi a vaccinazione con Comirnaty sono relativi alla classe organo-sistemica delle patologie generali e condizioni relative alla sede di somministrazione (75%), soprattutto febbre, dolore in sede di iniezione, stanchezza/astenia e malessere generale (non gravi nel 94% dei casi), seguiti dalle patologie del sistema muscoloscheletrico e del tessuto connettivo (41%), soprattutto mialgie, artralgie e dolore muscoloscheletrico (non gravi nel 95% dei casi). Complessivamente, il 7% delle segnalazioni al vaccino Comirnaty sono state inserite come gravi. Indipendentemente dal numero di dose e dal nesso di causalità, le reazioni più frequenti coincidono con la distribuzione di tutte le reazioni e sono rappresentate prevalentemente da febbre alta, cefalea intensa, dolori muscolari/articolari diffusi e astenia. Meno frequentemente sono riportate, invece, nausea, linfoadenopatia, parestesia, vomito, diarrea, vertigine e reazioni di tipo allergico e raramente, tachicardia, crisi ipertensiva o ipotensiva e paralisi facciale.
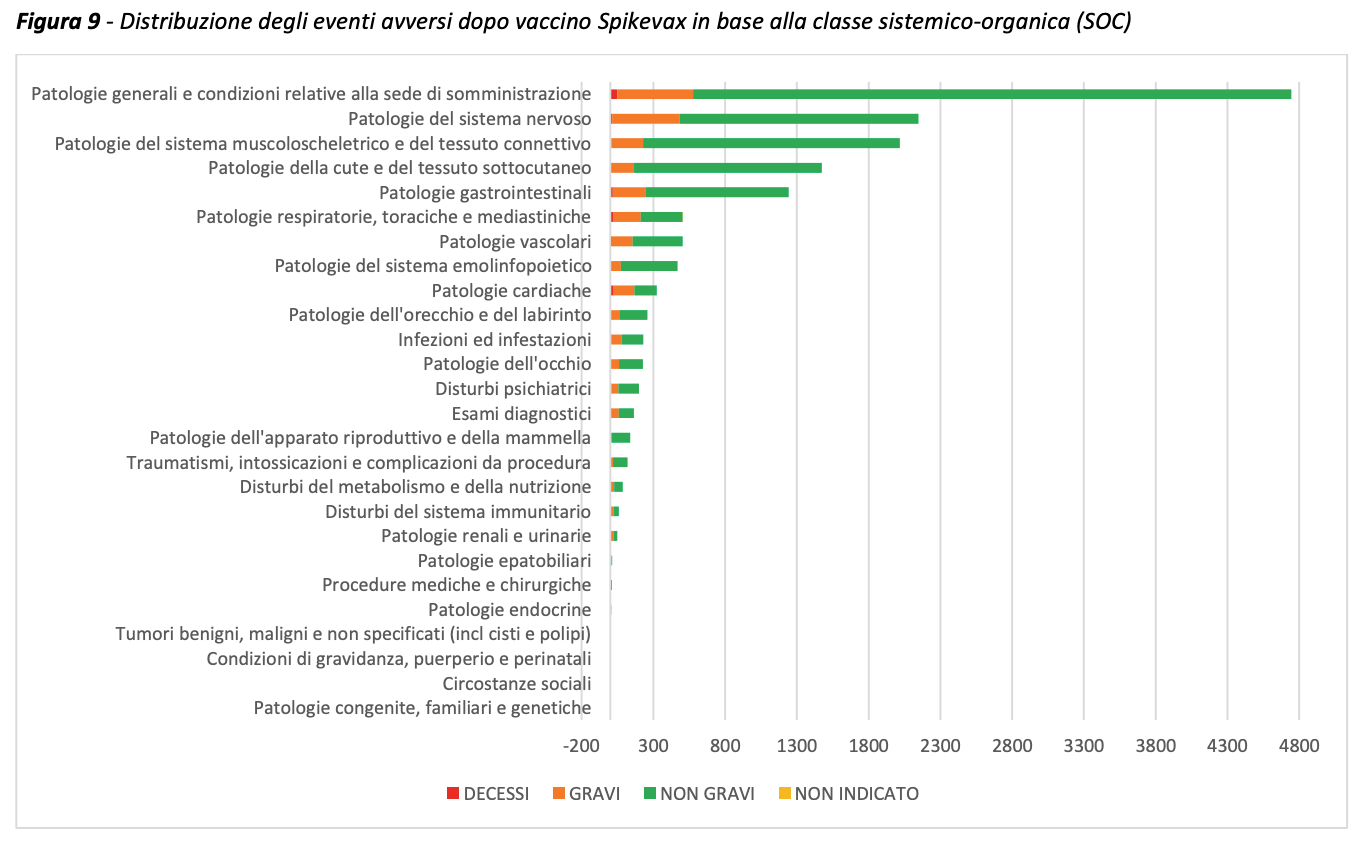
Vaccino Moderna mRNA -1273 (Spikevax)
La maggior parte degli eventi segnalati per il vaccino Moderna è relativa alla classe organo-sistemica Patologie generali e condizioni relative alla sede di somministrazione (74%) ed è rappresentata prevalentemente da febbre, dolore in sede di iniezione e astenia/stanchezza, per il 92% dei casi classificati come non gravi. Seguono in ordine di frequenza gli eventi che rientrano fra le Patologie del sistema nervoso (29%), soprattutto mal di testa, parestesie e capogiro, classificati come non gravi nel 79% dei casi. L’11% delle schede di segnalazione relative al vaccino Moderna riportano eventi avversi considerati gravi. Le reazioni gravi più frequenti corrispondono in parte alla distribuzione di tutte le segnalazioni e si riferiscono prevalentemente ai sintomi di tipo sistemico e a carico dell’apparato muscoloscheletrico (febbre alta, mialgie ed artralgie diffuse, ecc.). Arrossamento, orticaria ed eruzione cutanea nel sito di iniezione si sono verificati in meno di 1 persona su 10; prurito nel sito di iniezione ha interessato meno di 1 persona su 100; gonfiore al viso, che può riguardare coloro che si sono sottoposti in precedenza a iniezioni cosmetiche al viso, e debolezza nei muscoli di un lato del viso (paralisi/paresi facciale periferica acuta) si sono verificati raramente, in meno di 1 persona su 1000.
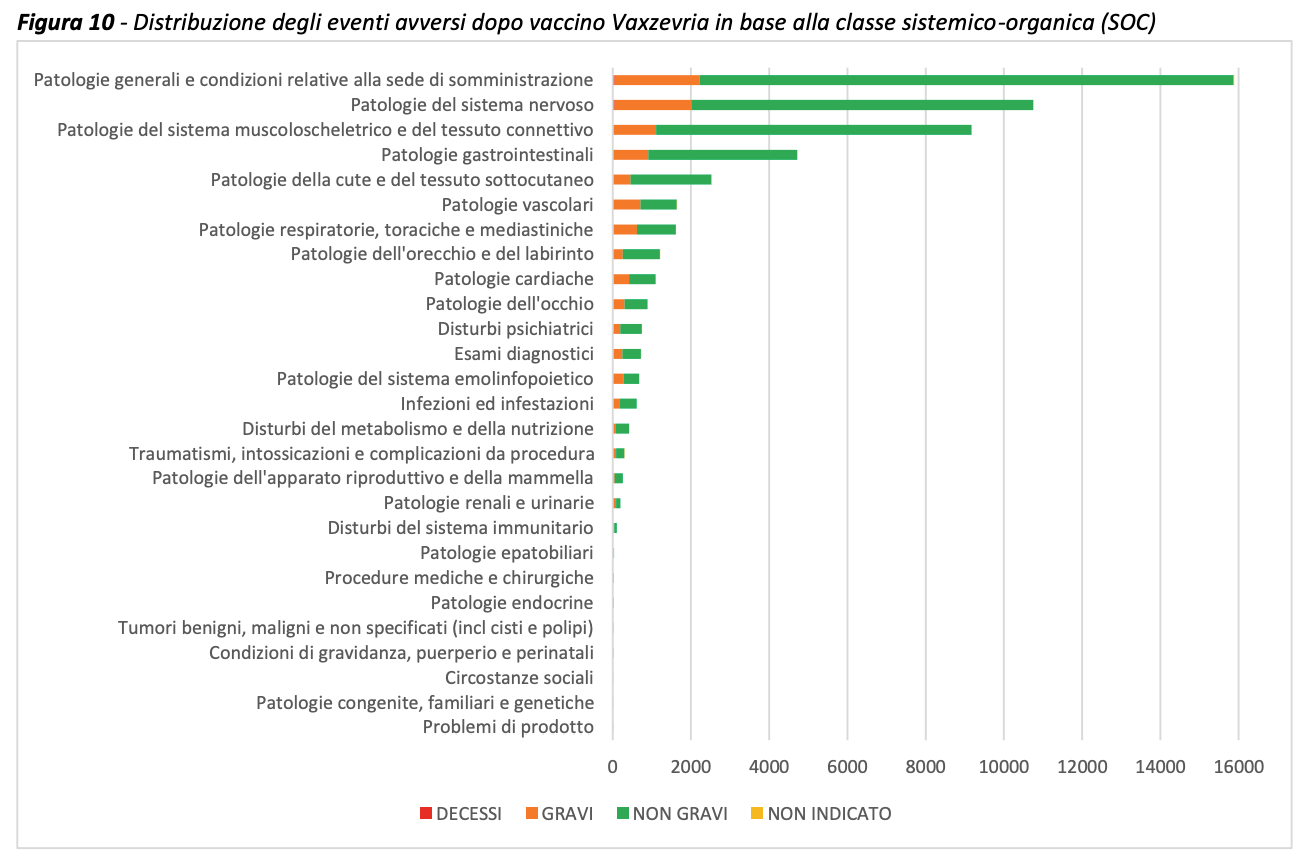
Vaccino Vaxzevria (ex COVID 19 Vaccine Astrazeneca)
La maggior parte degli eventi segnalati per il vaccino Vaxzevria è relativa alla classe organo-sistemica delle Patologie generali e condizioni relative alla sede di somministrazione (81%) ed è rappresentata prevalentemente da febbre, brividi, dolore in sede di iniezione e astenia/stanchezza. L’89% di queste segnalazioni sono classificate come non gravi. Seguono in ordine di frequenza eventi che rientrano fra le Patologie del sistema nervoso (53%), soprattutto mal di testa, parestesie e capogiro, classificati come non gravi nell’83% dei casi, e fra le Patologie del sistema muscoloscheletrico e del tessuto connettivo (49%), rappresentati soprattutto da dolori muscolari e articolari diffusi, classificati come non gravi nel 90% dei casi. Il 12,4% delle segnalazioni di eventi avversi per questo vaccino è riportato come grave e si riferisce prevalentemente a cefalea intensa e febbre alta con eventuali altri sintomi sistemici associati, soprattutto artralgie e mialgie. Altri termini preferiti riportati con frequenza inferiore sono: tremore, vertigine, sincope, sonnolenza e dolore generalizzato. Relativamente alle reazioni anafilattiche il numero di segnalazioni nel periodo è stato limitato, pertanto, non ci sono informazioni aggiuntive meritevoli di un focus dedicato in questa edizione del Rapporto.
Come illustrato nel precedente Rapporto, il Comitato per la Valutazione del Rischio in Farmacovigilanza (PRAC) dell’EMA ha valutato un segnale relativo ad eventi tromboembolici a seguito di vaccinazione con Vaxzevria nel mese di marzo 2021. Sulla base dei dati disponibili, gli unici eventi per i quali non era possibile escludere completamente un ruolo del vaccino erano rappresentati da trombosi dei vasi che drenano il sangue dal cervello (trombosi dei seni venosi intracranici o CSVT) e trombosi di più vasi sanguigni in sede atipica, in alcuni casi, associati a bassi livelli di piastrine (trombocitopenia).
Si tratta di eventi avversi molto rari, segnalati soprattutto in donne di età inferiore ai 55 anni, che sono stati valutati anche con il supporto di un gruppo interdisciplinare di esperti europei indipendenti. A seguito di questa seconda valutazione, l’EMA ha concluso che i benefici del vaccino restano complessivamente superiori ai rischi e che gli eventi trombotici venosi in sedi inusuali, soprattutto a livello delle vene cerebrali (trombosi dei seni venosi cerebrali – CSVT) e addominali (trombosi venosa splancnica), associati a bassi livelli di piastrine debbano essere elencati come effetti indesiderati molto rari di Vaxzevria.
Fonti
- AIFA, Agenzia Italiana del farmaco, Ottavo Rapporto AIFA sulla sorveglianza dei Vaccini COVID-19.
- CDC – Centers for Disease Control and Prevention, ‘Key Things to Know About COVID-19 Vaccines’.


Chiedi ai nostri esperti
Hai dubbi sul Covid-19? Vuoi sapere come dovresti comportarti in alcuni casi specifici? Cerchi risposte affidabili a domande che ti assillano? Gli esperti di HELPCOVID sono a tua disposizione. Scrivici e ti sapremo dare una risposta completa nel più breve tempo possibile.